Obok szczegółowej kontroli składników pokarmowych i EC poświęcamy także dużo uwagi pH pożywki. Dlaczego to robimy? Dlaczego pH jest tak istotne i jaki jest jego wpływ na roślinę?
Wartość pH stanowi ujemny logarytm stężenia jonów wodoru w roztworze. Współczynnik pH jest wobec tego wyznacznikiem kwasowości. Zmniejszenie lub zwiększenie pH o jeden punkt oznacza, że roztwór staje się dziesięć razy bardziej alkaliczny lub kwasowy. Jeden punkt odpowiada współczynnikowi dziesięć w stężeniu. Oznacza to, że pH o wartości cztery jest 1000 razy bardziej kwasowe niż pH wynoszące siedem! To dlatego pH odgrywa tak ważną rolę podczas uprawy. Zbyt kwaśna woda ma negatywny wpływ na roślinę oraz na środowisko w otoczeniu korzeni. Tę kwestię omówię szerzej w niniejszym artykule.

pH w czasie podlewania
Określona wartość pH jest standardowa dla podłoża roślin. Aby system korzeniowy dobrze się rozwijał, należy dbać by pH podłoża i w korzeniu niezbyt od siebie odstawały. Podczas podlewania chcemy w jak najmniejszym stopniu wpłynąć na zmianę wartości pH podłoża i korzeni. Utrzymując stabilne wartości zapewnimy roślinie lepszą absorpcję składników pokarmowych.
Pobieranie składników pokarmowych przez roślinę
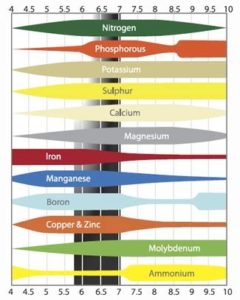
Współczynnik pH ma duży wpływ na pobieranie składników pokarmowych przez korzenie. Jeśli pH będzie zbyt wysokie lub zbyt niskie składniki pokarmowe nie będą optymalnie pobierane. Dla roślin idealny poziom pH pożywki jest pomiędzy pięć a sześć. Jeśli pH przekracza sześć roślina może mieć problemy z pobieraniem boru, miedzi oraz fosforanów. Przy wysokim pH dochodzi do wcześniejszego wytrącania się substancji zarówno w zbiorniku nawozowym jak i w rurach.
Jeśli pH jest zbyt niskie, czyli poniżej pięciu, roślinie ciężko będzie pobierać pozostałe składniki pokarmowe. Podstawowy problem zbyt niskiego pH polega na absorpcji molibdenu. Utrudnione jest także pobieranie azotu i siarki. W przypadku bardzo niskiego poziomu pH może dojść do zatrucia. Rośliny łatwo absorbują mangan i aluminium przy niskim pH, co może być dla nich toksyczne. Poniżej przedstawiam podsumowanie podanych informacji:
| Zła lub niemożliwa absorpcja przy pH ≤5 | Zła lub niemożliwa absorpcja przy pH ≥6 |
| Azot (N) | Bor (B) |
| Molibden (Mo) | Fosforany (PO) |
| Siarka (S) | Miedź (Cu) |
Pomimo, że zazwyczaj kontroluje się pH wody irygacyjnej, może dochodzić do różnic pomiędzy pH podłoża lub przesączu. Akumulacja pewnych elementów, które nie są pobierane przez rośliny lub zostają przez nie uwolnione, zazwyczaj wpływa na obniżenie pH. To wpływa na skład podłoża. Każde podłoże ma inne właściwości związane z bilansem nawilżenia, co ma wpływ na pH. W podłożu z minimalnym przesączem podnosi się poziom EC, co często oznacza spadek pH.
pH w zbiorniku nawozowym
Podczas dawkowania nawozu w zbiorniku nawozowym należy dopilnować, by poziom pH nie przekroczył sześciu. Najlepiej zachować pH pomiędzy cztery a pięć, by wszystko odpowiednio się rozpuściło. Ważne jest także, by żelazo nie znajdowało się w tym samym zbiorniku co kwas fosforowy i kwas azotowy. Kwasy powodują korozję chelatów żelaza, czego wynikiem jest oksydacja żelaza oraz łączenie się Fe3+ z O2, co w rezultacie daje niemożliwy do absorpcji Fe2O3 (rdzę).
Kontrola
Pomiaru pH należy dokonywać jak najszybciej po pobraniu próbki: pH wody ulega zmianie wraz z upływem czasu. Do pomiaru warto pobierać świeżą wodę, a nie starą, stojącą. Z tego względu nie ma najmniejszego sensu przesyłanie próbek do laboratoriów w celu analizy pH.
Należy regularnie czyścić mierniki pH oraz kalibrować je kilka razy w roku. Z upływem czasu sprzęt pomiarowy może się rozregulować i wskazywać niepoprawne wartości, co prowadzi do dostarczania roślinom wody z nieodpowiednim pH.
Wskaźnik ręczny
Czujnik miernika pH jest bardzo wrażliwy, dlatego lepiej nie dotykać go gołymi rękami. Może to prowadzić do uszkodzeń, a w konsekwencji do niepoprawnych wyników pomiarów. Czujnik powinien być czyszczony po każdym pomiarze. Zaleca się płukanie demineralizowaną wodą, by nie pozostawić na nim żadnych szkodliwych substancji. Ważne jest także, aby czujnik przechowywany był w wilgotnym środowisku, co pozwala uniknąć osadzania się suchych odpadów. W tym celu napełnia się zatyczkę specjalnym płynem do przechowywania.

Miernik stacjonarny
Pracując w systemie, w którym nawozy ze zbiornika mieszane są wyłącznie w szklarni, ważne jest, by miernik pH nie znajdował się zbyt blisko urządzenia do sporządzania mieszanki. Powinien być zlokalizowany od dwóch do trzech metrów od urządzenia mieszającego, w którym pH nie zostało jeszcze ustabilizowane.
Jeśli czujnik jest brudny, można go wyczyścić miękką szmatką, moczyć w roztworze wody z niewielką ilością mydła przez 15 minut lub moczyć go w alkoholu.
Wpływ roślin na pH
Sama roślina ma duży wpływ na pH, ponieważ selektywnie pobiera konkretne składniki pokarmowe. Jeśli kationy (dodatnio naładowane jony) oraz aniony (ujemnie naładowane jony) są absorbowane równomiernie, pH podłoża pozostaje bez zmian. Ładunek elektryczny rośliny musi pozostać neutralny. Oznacza to, że jeśli roślina pobiera na przykład potas (K+), będzie uwalniać wodór (H+). Jeżeli natomiast pobiera na przykład azotan (NO3–), będzie uwalniać anion wodorotlenkowy (OH–). Jeśli roślina absorbuje tyle samo kationów ile anionów, H+ połączy się z OH– tworząc neutralną wodę (H2O). Jeśli nie ma między nimi równowagi dochodzi do zmiany pH. Im większe uwalnianie jonów wodoru (H+), tym większy spadek pH, a im większe uwalnianie jonów wodorotlenkowych (OH–), tym bardziej wzrasta pH.
Ponieważ korzenie także oddychają produkują tym samym dwutlenek węgla (CO2). W konsekwencji dojdzie do reakcji CO2 z OH– i powstanie wodorowęglan (HCO3). Rośliny pobierają więcej kationów niż anionów, co wpływa na spadek pH.
W momencie, w którym roślina staje się generatywna, absorbuje więcej potasu (K+) i obniża się pH.
Azot (N) w formie amonowej (NH4+) przekształca się w azotan (NO3–). To powoduje, że stężenie wodoru (H+) w podłożu wzrasta i przyczynia się do spadku pH. Dlatego też bardzo ważne jest, by w przypadku podawania dużych ilości NH4+ dopilnować by poziom pH był wystarczająco wysoki. Oznacza to, że w lecie powinno wynosić ponad 5,5, natomiast w zimie trochę mniej, ponieważ rośliny potrzebują mniej azotu. Możemy to osiągnąć, redukując dawkę NH4+.
Buforowanie w podłożu
Można buforować pH w podłożu poprzez dodanie Dolokalu (CaCO3 + MgO). Kiedy Dolokal jest wymieszany z podłożem rozpuszcza się w glebie dosyć powoli. Podczas tego procesu uwalniane są pierwiastki, które wpływają na podniesienie poziomu pH. Zazwyczaj Dolokal zawiera 5% tlenku magnezu (MgO), jednak na rynku dostępny jest także Dolokal Extra z zwartością 10% MgO. Reakcja w glebie wygląda następująco:
CO32- à H+ + CO32- à HCO3–
HCO3– à H+ + HCO3– à H2O + CO2
Wodorowęglan (HCO3) to związek, który nie odżywia roślin, ale w dużym stopniu wpływa na pH podłoża. Im więcej jest HCO3 w podłożu tym bardziej wzrasta pH. W gliniastych podłożach ciężko jest wypłukać HCO3, w przeciwieństwie do otwartych podłoży, takich jak kora.
Buforowanie wodorowęglanu w podłożu wygląda następująco:
H2O + H+ à H3O + HCO3 à H2CO3 + H2O à 2H2O + CO2
Możemy zauważyć, ze wodorowęglan łączy się z H3O i ostatecznie przekształca się w wodę (H2O) i dwutlenek węgla (CO2).
Pożywka jest często buforowana potasem i można to osiągnąć na dwa sposoby: za pomocą węglanu potasu (K2CO3) lub wodorotlenku potasu (KOH). Węglan potasu działa powoli, dlatego rezultaty nie są widoczne od razu. Węglan potasu bezpośrednio wpływa na podwyższenie pH.
Fosforan również posiada właściwości buforujące i może być stosowany w różnych połączeniach. Związki fosforanowe o powyższych właściwościach są następujące:
PO43−, HPO42−, H2PO4− i H3PO4
W tym przypadku możemy zauważyć, że fosforan posiada potrójny efekt buforujący.
Uwagi
Rozpuszczalność żelaza zależy od dodanego rodzaju chelatu. Istnieją trzy różne chelaty stabilne przy różnych wartościach pH. Najmniej stabilnym chelatem jest EDTA, a najbardziej stabilnym jest EDDHA. Poniżej przedstawiam zestawienie z wartościami pH przy których poszczególne chelaty są stabilne.
| Rodzaj chelatu | Stabilny przy pH |
| EDTA | 3 – 6 |
| DTPA | 3 – 6,5 |
| EDDHA | 3 – 10 |
Jeśli chelat żelaza nie jest stabilny ulegnie rozpadowi i żelazo nie pozostanie rozpuszczone. To oznacza, że żelazo zmieni się z Fe2+ (rozpuszczonej) na Fe3+ (rdza). To właśnie dlatego bardzo ważny jest wybór odpowiedniego chelatu. Jeśli z chelatu zacznie uwalniać się żelazo, natychmiast dojdzie do utworzenia się nowych związków z wytrąconym żelazem, które nie będą już możliwe do absorpcji przez rośliny. Im silniejszy związek, tym droższe staje się żelazo, ponieważ proces produkcyjny jest droższy.
pH w uprawie falenopsis
W przypadku falenopsis ważne jest, by zdawać sobie sprawę, że pH w doniczce maleje w trakcie czasu uprawy. W fazie chłodzenia, przy indukcji pędów oraz wzrostu i rozwoju pędów falenopsis pobiera więcej potasu powodując spadek pH w podłożu.
Zimą falenopsis potrzebuje mniej azotu niż latem. Oznacza to, że pH może być nieco niższe, ponieważ roślina otrzymuje wystarczającą ilość azotu.

pH w uprawie anturium ciętego
Oprócz wpływu samych roślin anturium na pH, kwasowość zależy głównie od podłoża w którym rośliny są uprawiane. W przypadku wełny mineralnej pH pozostaje wysokie przez długi okres, natomiast przy perlicie pH w przesączu może ulec znacznemu obniżeniu już po sześciu miesiącach. Zachowanie oasisu bardzo zależy od stopnia uwapnienia. Coroczne wapnowanie Dolokalem/Dolomitem jest często niezbędne w uprawie w oasisie. W uprawie w perlicie pH przesączu może być zazwyczaj utrzymywane na poziomie 3,0 za pomocą właściwego pH i odpowiedniej ilości wodorowęglanu (HCO3-) w wodzie.
Dana odmiana może bardziej lub mniej wpływać na pH podłoża i przesączu. Z uwagi na wybiórczą absorpcję pierwiastków możemy zaobserwować, że w przypadku jasnych odmian (Moments®, Acropolis® i Angel®) pH szybko spada i dochodzi do bardzo niskich wartości, takich jak 2,0. Tak niskie poziomy pH utrudniają bardzo absorpcję Ca2+, co z kolei sprawia, że z trudem budowane są struktury komórkowe. W takim przypadku często dochodzi do szklistości lub sinienia kwiatów.

Szklisty kwiat z powodu niskiego pH
Poziom pH jest bardzo ważny dla roślin, dlatego nie zapominajmy nigdy o kontroli pH pożywki oraz czym karmimy rośliny. Jeżeli mają Państwo dodatkowe pytania lub jeśli życzą sobie Pastwo otrzymać więcej informacji na ten lub inny temat związany z technicznymi aspektami uprawy, prosimy o kontakt z Bureau IMAC Bleiswijk.





